Savoir équilibrer une équation de réaction
Lorsqu'on écrit une équation de réaction ou bien lorsque l'on fait la représentation d'une transformation chimique, il se pose la question du nombre d'atomes à représenter.
Lors d'une transformation chimique, aucun atome ne disparaît.
Lorsqu'on écrit le bilan d'une transformation chimique, ce problème ne se voit pas (les atomes sont "cachés" dans les noms)
Méthode : Méthode pour équilibrer une équation de réaction
Commencer par vérifier la conservation des atomes de carbone, puis des atomes d'oxygène et finir par les atomes d'hydrogène.
Exemple : Exemple pour la combustion du méthane
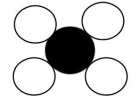
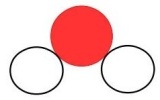
Le bilan est : méthane + dioxygène → eau + dioxyde de carbone
Simple remplacement des noms des molécules par leur représentation ou leurs formules :
méthane | + | dioxygène | → | eau | dioxyde de carbone |
+ |
| → |
|
Il y a 1 atome de carbone et 1 atome de carbone après la flèche : C'est correct pour le carbone.
Il y a 2 atomes d'oxygène avant mais 3 après la flèche.
On ne peut changer les formules des molécules mais seulement dire combien réagissent ou apparaissent.
Essaie des combinaisons simples et vérifie s'il y a autant d'atome d'oxygène avant qu'après la flèche :
2 dioxygène donnent 1 eau et 1 dioxyde de carbone
2 dioxygène donne 2 eau et 1 dioxyde de carbone
2 dioxygène donne 1 eau et 2 dioxyde de carbone
Réécris la représentation avec les nombres corrects de molécules et réapplique la même méthode avec les atomes d'hydrogène.